Peróxido de hidrogênio
Origem: Wikipédia, a enciclopédia livre.
| Fórmula estrutural | |
|---|---|
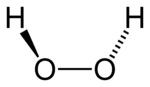   |
|
| Geral | |
| Nome IUPAC | Peróxido de hidrogênio |
| Nomes usuais | Água oxigenada peróxido de di-hidrogênio dióxido de diidrogênio |
| Fórmula química | H2O2 |
| Massa molar | 34.01475 g/mol |
| Aparência | Líquido claro |
| Número do CAS | 7722-84-1 |
| Comportamento de fase | |
| Ponto de fusão | 262 K (-11°C) |
| Ponto de ebulição | 414 K (141°C) |
| Propriedades sólidas | |
| ΔfH0sol | -200 kJ kJ/mol |
| S0sol | ? J/mol·K |
| Propriedades líquidas | |
| Densidade | 1,476 g/cm³ |
| Solubilidade em água | miscível |
| Viscosidade | 1,245 cP a 20°C |
| ΔfH0liq | -188 kJ/mol |
| S0liq | 110 J/mol·K |
| Propriedades gasosas | |
| ΔfH0liq | -136,11 kJ/mol |
| S0liq | 232,95 J/mol·K |
| Segurança | |
| Símbolos de risco | |
 C Corrosivo |
|
| Instruções de Risco e Segurança | R: 34 S: 3-26-36/37/39-45 |
| Ponto de fulgor | não inflamável |
| Ingestão | Problemas sérios, possível morte. |
| Inalação | Irritação severa. Possível morte. |
| Mais informações | |
| MSDS | Hazardous Chemical Database |
| Unidades do SI são usadas quando possível. Salvo quando especificado o contrário, são considerados condições normais de temperatura e pressão. | |
Trata-se de um líquido viscoso e poderoso oxidante. É incolor à temperatura ambiente e apresenta característico sabor amargo. Quantidades pequenas de peróxido de hidrogénio gasoso ocorrem naturalmente no ar. O peróxido de hidrogénio é instável e quando perturbado, rapidamente se decompõe (através da enzima Catalase, presente em nosso corpo), de H2O2, em água(H2O) e oxigênio(O2) com libertação de calor. Deste modo, quando ele é transformado em água e oxigénio pela catalase, acaba por matar bactérias e vírus anaeróbicos (que não sobrevivem à presença de oxigénio), pois libera oxigénio puro, tendo a função de "Desinfectante Oxidante". Embora não seja inflamável, é poderoso agente oxidante que pode sofrer combustão espontânea em contacto com matéria orgânica ou alguns metais como o cobre ou o bronze.
O peróxido de hidrogénio é encontrado em concentrações baixas (3-9%) em muitos produtos domésticos para uso medicinal e como clareador da roupa e do cabelo. Na indústria, o peróxido de hidrogénio é usado em concentrações mais elevadas para clarear tecidos, pasta de papel, e ainda como combustível para ajuste e correcção nas trajectórias e órbitas de satélites artificiais no espaço. Na área médica é usado como desinfectante ou agente esterilizante em autoclave de plasma. Na área química é usado como componente da espuma de borracha orgânica e outras substâncias químicas. Noutras áreas como na investigação é usado para medir a actividade de algumas enzimas como a catalase.
O peróxido de hidrogénio actua ainda em diversos mecanismos de degradação de aminoácidos (em associação com amino-oxidases), por conta de seu poder oxidante elevado. Tal composto ainda pode actuar na fotossíntese (ciclo do glioxilato), e na síntese de glicose a partir de fontes que não contenham carboidratos (gliconeogénese).
Usos gerais
- clareamento de cabelos;
- como antisséptico a 3%;
- usada junto com o peróxido de benzoíla no tratamento da acne;
- no clareamento dental.
- na medicina veterinária.
- em processos de esterilização a baixa temperatura, na forma de plasma.
Referências
- ↑ L. J. Thénard. (1818). "Observations sur des nouvelles combinaisons entre l’oxigène et divers acides". Annales de chimie et de physique, 2nd series 8: 306–312.
Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.